谁是化合物界的“标题党”?——Chem带你看脱氢醋酸的制备 | 锇钔实验人 第六期
时隔多日,锇钔实验人终于又和大家见面啦。在上一期的锇钔实验人中,我们学习了“硝酸钾的制备”,温习了最基础的实验操作,而我们今天的主角是一种涉嫌“标题欺诈”的有机物——脱氢醋酸

下面就请大家跟随Chem的脚步,一起回顾经典化学实验“脱氢醋酸的合成”。
“名不副实”——脱氢醋酸的制备
【产品介绍&原理简介】
脱氢醋酸,又称脱氢乙酸,简称DHA,分子式为C8H8O4,分子量为168.15,是一种无色结晶或浅黄色粉末,在水中以及苯、乙醚、丙酮、热乙醇等有机溶剂中均难溶。

脱氢醋酸,也许是本科阶段接触到的纷繁实验中,最“名不副实”的一个,虽然名字里带醋酸,但在制备过程中,脱氢醋酸却和醋酸没有什么联系。
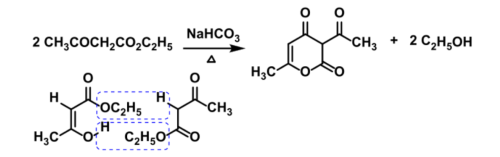
实验室中制备脱氢醋酸,使用到的原料是乙酰乙酸乙酯(俗称“三乙”,是一类应用广泛的有机合成原料),利用烯醇式的乙酰乙酸乙酯与酮式的乙酰乙酸乙酯发生酯缩合与酯交换反应,脱除两分子乙醇,就可以得到产物脱氢醋酸。
【操作指北】
Step1.在三口瓶中加入30ml乙酰乙酸乙酯,15mgNaHCO3与数粒沸石,安装好分馏装置,此实验中使用的冷凝管是刺形分馏柱,可以使蒸气在上升过程中产生多次液-气平衡,达到多次简单蒸馏的效果,最终分离得到几乎纯态的液体与蒸气。

Step2.在反应过程中,注意刺形分馏柱中蒸气上升的速度,大约10-15min到达柱顶,并控制加热速度,使柱顶的温度计示数在60-80℃之间。

Step3.随着反应开始,控制反应瓶中的温度在190℃左右,由于乙醇沸点低,乙酰乙酸乙酯沸点高,乙醇蒸气会达到分馏柱塔顶离开体系,而未反应完的原料则会在多次蒸发-冷凝的循环中,沿着刺形分馏柱降回三口瓶内,同时因为产物乙醇的不断析出,反应平衡右移,不断推进产物生成。

Step4.将反应后的混合物倒入烧杯中,在烧杯上盖一块表面皿,随后将烧杯放在冰水浴中冷却析晶,抽滤洗涤后,得到粗产物。

Step5.搭建好水蒸气蒸馏装置,将抽滤后得到的粗产物放进三口瓶中,用稀硫酸保持三口瓶中pH始终为2-3之间,开始水蒸气蒸馏。

Step6.当水蒸气蒸馏的尾接管中不再有固体随水滴滴出时,分离纯化工作就基本结束了,此时再次抽滤就可以得到较纯的产物——脱氢醋酸。

【要点分析】
1、在安装分馏反应装置时,使用了两支温度计,250℃的水银温度计用于检测三口瓶中的温度,100℃的酒精温度计用于检测柱顶的温度,实验中要注意温度计的匹配与插入位置。
2、在制备反应时,时刻都要注意适量问题,如:实验中的碳酸氢钠作为弱碱用于催化反应,但过强或者过多的碱会导致一系列副反应;实验中乙醇是产物,及时脱除乙醇是得到高产率的必要条件,但是过高的柱顶温度也会导致没来得及反应的原料损失,反而降低产率;实验过程中应让蒸气较慢通过分馏柱,使热交换充分,令乙醇充分脱除,但若过慢,则大大加长反应时间,且乙醇脱除不彻底,产率降低……
3、水蒸气蒸馏有一定的危险性,要注意防止烫伤,实验装置中三口瓶内的物质量应控制在容积的1/3以下,在水蒸气蒸馏过程中要保证各橡皮管和连接通道的畅通,注意安全管水面的高低,防止沸水喷溅,结束实验时要先旋开T形管通大气,再移去热源。
4、水蒸气蒸馏过程中要注意保持体系pH在2-3之间,抑制副反应发生,防止脱氢醋酸发生烯醇互变,同时由于水蒸气蒸馏时由大量产物(白色晶体)随水蒸气带出,因此为了防止尾接管小口堵塞,蒸馏时可不带尾接管。
实验基本操作——水蒸气蒸馏
【方法介绍】
水蒸气蒸馏是分离纯化有机化合物的重要方法之一,也是所有化学人在本科期间所必须要掌握的一种重要的分离纯化方法。
水蒸气蒸馏将水蒸气通入含有不溶或微溶于水但有一定挥发性的有机物的混合物中,使待提纯的有机物在低于100℃的情况下就能随水蒸气一起被蒸馏而出,达到分离效果。
【基本原理】
当水与有机物共热时,整个体系的蒸气压根据分压定律,是各组分蒸气压的和,P=PA+PB,其中P为总蒸气压,PA为水的蒸气压,PB为不溶于水的化合物的蒸气压,当混合物中各组分的蒸气压总压等于外界大气压时,混合物开始沸腾,而混合物的沸点比任何一组分的沸点都要低,因此在常压下,水蒸气蒸馏能在低于100℃的情况下能将高沸点组分与水一起蒸出来。
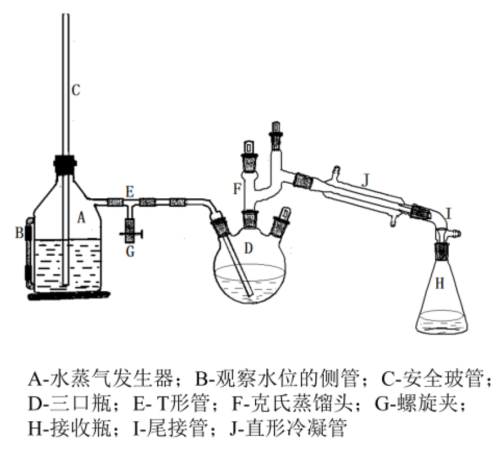
【实验操作&注意事项】
水蒸气蒸馏主要由水蒸气发生器,三口瓶与长的直形冷凝管组成,操作前需要注意检查水蒸气蒸馏装置的气密性,将发生器中的液面调节到容积的1/3到2/3位置,烧瓶内放入待蒸馏的物质。
开始蒸馏时要先打开T形管,直到水蒸气发生器中的水被加热到产生大量蒸气后,关闭T形管,打开冷凝水并开始蒸馏,这时可以看到烧瓶中的化合物翻腾不息,不久就在冷凝管中出现水和有机物的混合物,调节热源控制馏出液的馏出速度,并让瓶内混合物不至于由于水蒸气进入过快而飞溅。当馏出液澄清透明,几乎看不到有机物液滴或固体时即可停止蒸馏,此时需旋开T形管,再移去热源
需要注意的是,水蒸气蒸馏法适用于长时间与水共沸且不与水反应的物质,且该物质在接近100℃时候应该具有一定的蒸气压,一般不小于13.33kPa。
以上就是Chem本次和大家分享的全部内容啦,刺形分馏柱的操作与水蒸气蒸馏的原理都是基础有机实验中需要掌握的重点操作,屏幕前的小伙伴们都学会了吗。
最后,依然欢迎各位化学人来和Chem酱“诉说里短”,分享属于自己的实验经,Chem期待在未来的推送里能看到更多小伙伴们精彩的实验故事,让我们下期再见。







